
科研服务
荧光定量PCR技术于1996年由美国Applied Biosystems公司推出,由于该技术不仅实现了PCR从定性到定量的飞跃,而且与常规PCR相比,它具有特异性更强、有效解决PCR污染问题、自动化程度高等特点,目前已得到广泛应用。 荧光定量PCR技术是通过荧光染料或荧光标记的特异性探针,对PCR产物进行标记跟踪,实时监控反应过程。随着PCR 反应的进行,反应产物不断累积,荧光信号强度也等比例增加。每经过一个循环,收集一次荧光强度信号,这样就可以通过荧光强度变化监测产物量的变化,结合相应的软件对产物进行分析,可以得到荧光扩增曲线,计算待测样品初始模版的量。实时荧光定量PCR技术是一次由定性技术向定量技术的飞跃,运用该项技术,可以对DNA、RNA样品进行相对定量、绝对定量和定性分析。
产品内容
| 项目类型 | 检测方法 | 荧光定量PCR服务价格 | 周期 | ||
|---|---|---|---|---|---|
| 荧光定量PCR服务 | SYBR Green染料法taqman探针法 | 位点调试费 | RNA提取+逆转录 | 定量pcr三复孔 | 5-8个工作日 |
| 100元/基因 | 70元/样品 | 70元/基因/样品 | |||
1、绝对定量,标准曲线另外收取(300元/基因)。
2、探针法,探针需另外收取费用(500元/条,默认FAM、BHQ)。
检测分类
- 1. mRNA表达量水平检测:相对定量法。
- 2. MicroRNA表达量水平检测:通过设计特殊茎环结构的反转录引物,结合实时定量PCR可以精确检测微量样品中microRNA表达水平。内参基因一般用U6。
- 3. 基因拷贝数检测:如检测样品中不同细菌含量、基因工程菌目的基因拷贝数、环境中耐药基因检测等。采用绝对定量法。
定量方式
- 1. 绝对定量:用已知浓度的标准品绘制标准曲线,而后通过标准曲线对未知浓度的检测样品进行绝对量(起始拷贝数)分析。
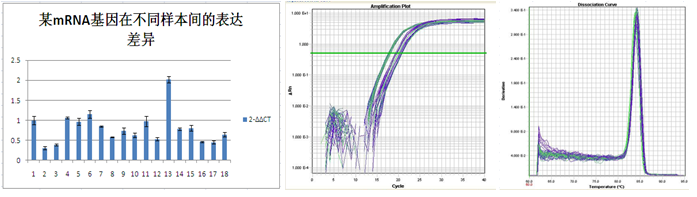
- 2. 相对定量:以内参基因为参照,比较两个或两个以上样本中某个基因表达量的变化,通常用来对mRNA表达量进行分析。一般采用2-ΔΔ Ct 法进行计算。每个样本重复三次。
检测方法
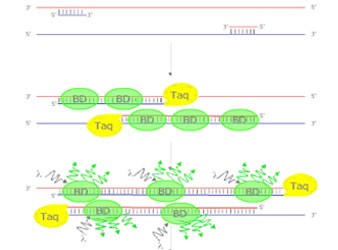
1. SYBR Green Ⅰ法:
在PCR反应体系中,加入过量SYBR荧光染料,SYBR荧光染料特异性地掺入DNA双链后,发射荧光信号,而不掺入链中的SYBR染料分子不会发射任何荧光信号,从而保证荧光信号的增加与PCR产物的增加完全同步。
|
|

|
|
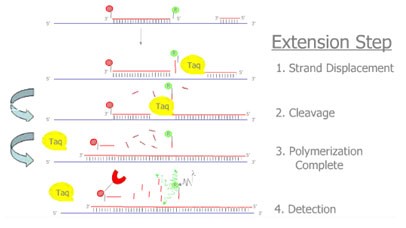
2. TaqMan探针法:
探针完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5’-3’外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物的形成完全同步。
样品要求
- 1、须提供新鲜的足量材料(细胞数106个以上,组织100 mg以上),样品-70℃快递至本公司(干冰或液氮运送,以保证样品质量),亦可提供保证质量的DNA或RNA样品(2 μg以上);
- 2、提供靶基因信息,包括基因序列或GenBank Accession Number等。
- 3、提供详细的背景资料,生物物种信息(Human、Mouse、Rat等)、DNA/RNA来源、基因丰度等。
提供结果
引物和探针及序列,胶图,原始数据(包括扩增曲线和熔解曲线)、数据分析结果及实验报告。
检测周期
常规检测任务2-3周内完成,具体情况根据要检测的基因和样本数而定。
常见问题
Q: 如何选择合适的内参基因?
A:常见物种做mRNA使用actin做内参,miRNA检测使用U6做内参,特殊物种根据文献选择合适的内参。对于一些无法确定内参的物种,我们可以提供内参基因筛选服务,选出稳定的内参用于后续实验。
Q: 引物出现非特异怎么解决?
A:提高退火温度;减少引物量;重新设计引物。
Q: 绝对定量与相对定量有什么区别?
A:绝对定量的目的是测定目的基因在样本中的分子数目,即通常所说的拷贝数。相对定量的目的是测定目的基因在两个或多个样本中的含量的相对比例,而不需要知道它们在每个样本中的拷贝数。绝对定量实验必须使用已知拷贝数的绝对标准品,必须做标准曲线。相对定量可以做标准曲线,也可以不做标准曲线。相对定量实验有两种方法:标准曲线法和CT值比较法。如果使用标准曲线法,可以使用绝对标准品,也可以使用相对标准品,而且相对标准品在实验操作上更为简便易行。相对标准品是只知道样品中DNA或RNA的稀释比例而不需要知道其分子数目的标准品,典型的做法是将一个已知pg数的样品做一系列梯度稀释。
Q: 每个反应管中可以加入多少种探针?
A:每个反应管中可以加入的探针数目,取决于仪器、软件、试剂和实验设计等几个方面。
首先是仪器的硬件构成和软件的解析能力。在软件解析能力足够的前提下,全波长检测的定量PCR仪如激光管-CCD类型对于探针的数量实际上是没有限制的。如果信号的采集要通过滤色片,那么探针的数量取决于滤色片的数目,增加探针需要增加或改变滤色片。改动仪器的结构通常很困难。以ABI公司的仪器为例,7900和7700是激光-全波长检测的,7000、7300是4色滤色片的,7500是5色滤色片的。
其次是化学上的可能性。不同的荧光基团要组合到一起,在同一反应管内使用,必须其激发波长既相对靠近又不能靠得太近,既保证信号激发的效率又保证信号不重叠干扰,能够区分清楚。现已发现的荧光基团种类有限,满足这样条件的分子组合更少。目前的最佳组合只能达到每组4到5种荧光的水平。
第三是实验方案的设计和选用的探针类型。定量PCR实验必须使用ROX校正荧光,占去一种荧光;TaqMan探针的淬灭基团(TAMRA)也要占用一种荧光,对于4色检测的仪器来说,只剩下2种荧光可以标记探针,对于5色检测的仪器还有3种荧光可以使用。如果将探针改用TaqMan MGB探针,由于它的淬灭基团是不发荧光的,比之TaqMan探针就可以多1种荧光用于标记探针。如果实验要求不高,不做ROX校正(AB公司不推荐这样做),还可以再多一种荧光用于标记探针。
第四是研究应用本身的要求。如果研究SNP和基因突变,因为绝大多数人类基因是2态的,只存在两种等位基因,2条探针已经足够。如果研究基因表达,通常是两两比较居多,比如处理比未处理,正常比异常等,加上一个内对照,3色也就足够了。
最后是成本控制方面的要求。多重定量的目的一是提高数据精确度,二是节省反应成本。同时测定的基因越多,成本也越低。但是加入4-5种探针,就要同时加入8-10条引物。在引物设计的时候要考虑到尽量减少这些引物之间的竞争和抑制等多种干扰,平衡各对引物之间的PCR效率。虽然这是可以做到的,但是要花费大量时间、人力和物力来筛选最佳引物组合、优化反应条件。如果实验规模不大,在总体上可能反而不合算。
在实际应用中,不是单纯追求加入的探针越多越好,而是追求总体效益的最优化。比较切合实际的是2到3重反应,引物和探针的设计不太困难,反应条件的优化也不太麻烦,同时降低了成本。
Q: 什么是双标准曲线法?
A:双标准曲线法是指将内参基因及目的基因分别稀释5个点,做标准曲线,以确保扩增效率,再根据绝对定量的数据计算差异表达情况。
订购信息
下载产品订购表或产品订购合同并按要求填写后发送至 tech@generalbiol.com ,公司收到订单或产品订购合同会及时与您回复及确认,并安排相关人员生产发货。
- 订单或合同下载 为保证您的订单或订购合同顺利上传,请您下载最新订单或订购合同。
- 邮箱: tech@generalbiol.com
- 电话: 0550-3121666转8820


